Exemplos De Ligações Ionicas E Covalentes – Exemplos De Ligações Iônicas E Covalentes representam um conceito fundamental em química, elucidando como átomos se unem para formar moléculas e compostos. Compreender esses tipos de ligações é crucial para desvendar as propriedades e reatividade de diversas substâncias, desde os sais que utilizamos no dia a dia até as complexas biomoléculas que sustentam a vida.
Neste estudo, iremos explorar as características distintivas das ligações iônicas e covalentes, examinando exemplos específicos e analisando suas propriedades. A regra do octeto, um princípio fundamental que guia a formação de ligações, será abordada em detalhe, fornecendo uma base sólida para a compreensão da estrutura e comportamento de moléculas.
Introdução às Ligações Químicas: Exemplos De Ligações Ionicas E Covalentes
A formação de compostos químicos, que são a base da matéria que nos rodeia, é um processo que envolve a interação entre átomos. Essas interações, conhecidas como ligações químicas, determinam a estrutura, propriedades e reatividade das moléculas. As ligações químicas são responsáveis pela estabilidade dos átomos, que tendem a atingir uma configuração eletrónica semelhante à dos gases nobres, que são extremamente estáveis.
Tipos de Ligações Químicas
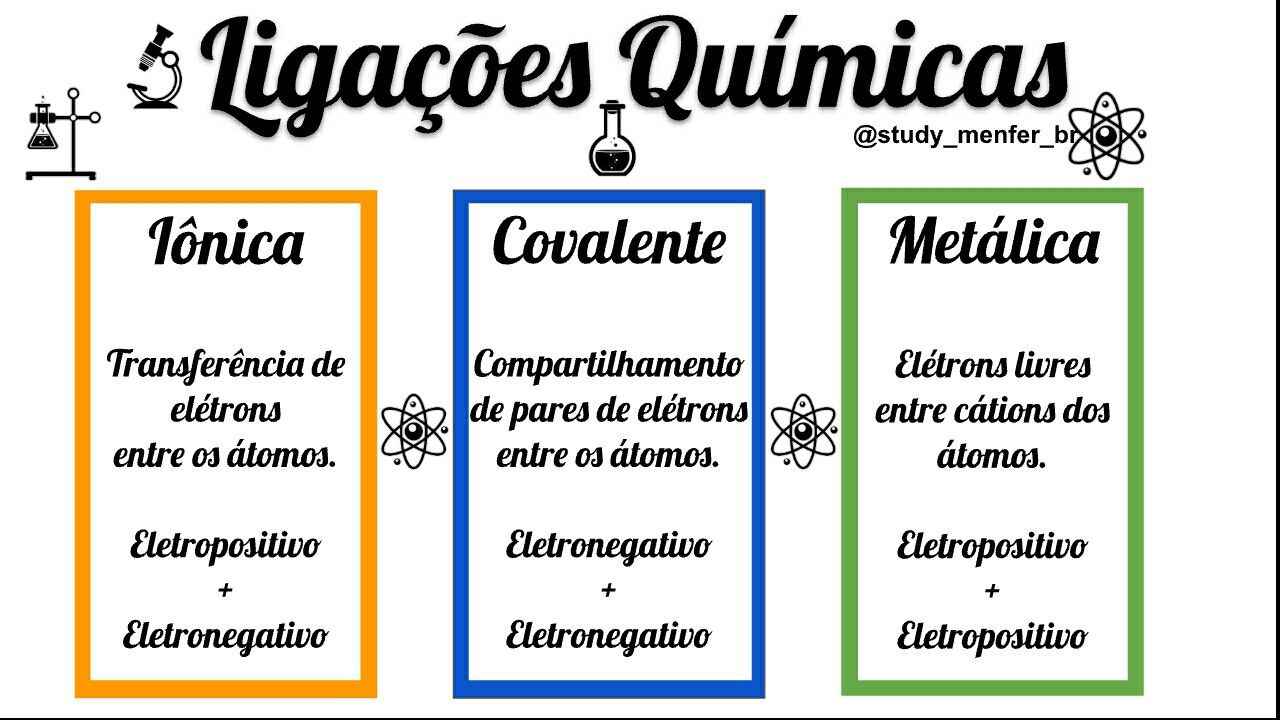
As ligações químicas podem ser classificadas em três tipos principais: iônica, covalente e metálica. A natureza da ligação química depende da diferença de eletronegatividade entre os átomos envolvidos.
- Ligação Iônica: Caracterizada pela transferência de eletrões de um átomo para outro, formando íons de carga oposta, que se atraem eletrostaticamente. Essa ligação ocorre tipicamente entre metais e não metais, onde o metal tende a perder eletrões e o não metal tende a ganhá-los.
Um exemplo clássico é a formação do cloreto de sódio (NaCl), onde o sódio (Na) perde um eletrão para o cloro (Cl), formando o íon sódio (Na+) e o íon cloreto (Cl-), que se atraem formando a ligação iônica.
- Ligação Covalente: Caracterizada pelo compartilhamento de pares de eletrões entre átomos, formando moléculas. Essa ligação ocorre tipicamente entre não metais, onde ambos os átomos tentam completar a sua camada de valência. Um exemplo é a molécula de água (H2O), onde cada átomo de hidrogénio compartilha um par de eletrões com o átomo de oxigénio.
- Ligação Metálica: Caracterizada pela formação de um “mar de eletrões” deslocalizados, onde os átomos metálicos compartilham os seus eletrões de valência. Essa ligação ocorre entre átomos de metais, explicando a sua alta condutividade elétrica e térmica, maleabilidade e ductilidade. Um exemplo é o cobre (Cu), onde os átomos compartilham os seus eletrões de valência, formando um mar de eletrões que permite a livre movimentação dos eletrões e a condutividade elétrica.
Regra do Octeto
A regra do octeto é um princípio fundamental na química que explica a formação de ligações químicas. Esta regra afirma que os átomos tendem a ganhar, perder ou compartilhar eletrões para atingir uma configuração eletrónica estável, semelhante à dos gases nobres, com oito eletrões na sua camada de valência.
Esta regra é uma ferramenta útil para prever a formação de ligações químicas e a estrutura das moléculas.
A regra do octeto não é absoluta, pois existem exceções, como por exemplo, os elementos do terceiro período e posteriores, que podem ter mais de oito eletrões na sua camada de valência.
Ligações Iônicas

Uma ligação iônica é um tipo de ligação química que envolve a atração eletrostática entre íons com cargas opostas. Essa ligação ocorre quando um átomo, geralmente um metal, doa um ou mais elétrons para outro átomo, geralmente um não metal, formando íons carregados positivamente (cátions) e negativamente (ânions), respectivamente.
A força de atração entre esses íons de carga oposta mantém os átomos unidos, formando um composto iônico.
Formação de Ligações Iônicas
A formação de uma ligação iônica envolve a transferência de elétrons de um átomo para outro. O átomo que perde elétrons torna-se um cátion, enquanto o átomo que ganha elétrons torna-se um ânion. A atração eletrostática entre os íons de carga oposta é a força que mantém os átomos unidos.Por exemplo, na formação do cloreto de sódio (NaCl), um átomo de sódio (Na) perde um elétron para um átomo de cloro (Cl).
O sódio, com um elétron a menos, torna-se um cátion Na+, enquanto o cloro, com um elétron a mais, torna-se um ânion Cl-. A atração eletrostática entre os íons Na+ e Cl- é a força que mantém os átomos unidos, formando o composto iônico NaCl.
Exemplos de Compostos Iônicos
Existem muitos exemplos de compostos iônicos na natureza. Alguns dos compostos iônicos mais comuns incluem:
- Cloreto de sódio (NaCl) – Sal de cozinha
- Óxido de magnésio (MgO) – Usado na produção de cimento
- Cloreto de cálcio (CaCl2) – Usado como agente de degelo
- Brometo de potássio (KBr) – Usado como anticonvulsivante
Propriedades dos Compostos Iônicos
Os compostos iônicos têm propriedades características que os distinguem dos compostos covalentes. Essas propriedades incluem:
Ponto de Fusão e Ebulição
Os compostos iônicos geralmente têm altos pontos de fusão e ebulição. Isso ocorre porque as fortes forças de atração eletrostática entre os íons requerem muita energia para serem rompidas.
Solubilidade
Os compostos iônicos são geralmente solúveis em água. Isso ocorre porque as moléculas de água são polares e podem interagir com os íons, rompendo as ligações iônicas.
Condutividade Elétrica
Os compostos iônicos são geralmente bons condutores de eletricidade quando fundidos ou dissolvidos em água. Isso ocorre porque os íons são livres para se mover e carregar corrente elétrica.
Tabela de Compostos Iônicos
| Nome | Fórmula | Estrutura de Lewis | Propriedades |
|---|---|---|---|
| Cloreto de sódio | NaCl | [Na]+ [Cl]- | Sólido branco, alto ponto de fusão, solúvel em água, bom condutor de eletricidade quando fundido ou dissolvido em água |
| Óxido de magnésio | MgO | [Mg]2+ [O]2- | Sólido branco, alto ponto de fusão, insolúvel em água, bom condutor de eletricidade quando fundido |
| Cloreto de cálcio | CaCl2 | [Ca]2+ [Cl]- [Cl]- | Sólido branco, alto ponto de fusão, solúvel em água, bom condutor de eletricidade quando fundido ou dissolvido em água |
| Brometo de potássio | KBr | [K]+ [Br]- | Sólido branco, alto ponto de fusão, solúvel em água, bom condutor de eletricidade quando fundido ou dissolvido em água |
Ligações Covalentes
As ligações covalentes são um tipo fundamental de ligação química que envolve o compartilhamento de pares de elétrons entre átomos. Esse compartilhamento permite que os átomos atinjam uma configuração eletrônica estável, semelhante à dos gases nobres, e formem moléculas estáveis.
Tipos de Ligações Covalentes
As ligações covalentes podem ser classificadas em três tipos principais, de acordo com o número de pares de elétrons compartilhados:
- Ligação Covalente Simples:Um par de elétrons é compartilhado entre dois átomos. Por exemplo, na molécula de hidrogênio (H 2), cada átomo de hidrogênio compartilha um elétron com o outro, formando uma ligação simples.
- Ligação Covalente Dupla:Dois pares de elétrons são compartilhados entre dois átomos. Por exemplo, na molécula de oxigênio (O 2), cada átomo de oxigênio compartilha dois elétrons com o outro, formando uma ligação dupla.
- Ligação Covalente Tripla:Três pares de elétrons são compartilhados entre dois átomos. Por exemplo, na molécula de nitrogênio (N 2), cada átomo de nitrogênio compartilha três elétrons com o outro, formando uma ligação tripla.
Exemplos de Compostos Covalentes
Existem muitos exemplos de compostos covalentes, incluindo:
- Água (H2O): A água é uma molécula covalente com duas ligações simples entre o átomo de oxigênio e cada átomo de hidrogênio.
- Dióxido de Carbono (CO2): O dióxido de carbono é uma molécula covalente com duas ligações duplas entre o átomo de carbono e cada átomo de oxigênio.
- Amônia (NH3): A amônia é uma molécula covalente com três ligações simples entre o átomo de nitrogênio e cada átomo de hidrogênio.
- Metano (CH4): O metano é uma molécula covalente com quatro ligações simples entre o átomo de carbono e cada átomo de hidrogênio.
Tabela de Propriedades de Compostos Covalentes
| Nome | Fórmula | Estrutura de Lewis | Propriedades |
|---|---|---|---|
| Água | H2O | [Ilustração da estrutura de Lewis da água] | Líquido à temperatura ambiente, polar, bom solvente para muitas substâncias |
| Dióxido de Carbono | CO2 | [Ilustração da estrutura de Lewis do dióxido de carbono] | Gás à temperatura ambiente, apolar, não solúvel em água |
| Amônia | NH3 | [Ilustração da estrutura de Lewis da amônia] | Gás à temperatura ambiente, polar, solúvel em água |
| Metano | CH4 | [Ilustração da estrutura de Lewis do metano] | Gás à temperatura ambiente, apolar, não solúvel em água |
Comparação entre Compostos Iônicos e Covalentes
Os compostos iônicos e covalentes apresentam diferenças significativas em suas propriedades, devido à natureza de suas ligações químicas:
| Propriedade | Compostos Iônicos | Compostos Covalentes |
|---|---|---|
| Ponto de Fusão e Ebulição | Altos | Baixos |
| Condutividade Elétrica | Condutores em estado líquido ou fundido | Não condutores em estado líquido ou fundido |
| Solubilidade | Solúveis em solventes polares, como água | Solúveis em solventes apolares, como éter e benzeno |
| Força das Ligações | Fortes | Fracas |
Polaridade das Ligações Covalentes
A polaridade das ligações covalentes é determinada pela diferença de eletronegatividade entre os átomos que compartilham os elétrons. Se a diferença de eletronegatividade for grande, a ligação será polar, com uma extremidade da ligação tendo uma carga parcial negativa (δ-) e a outra extremidade tendo uma carga parcial positiva (δ+).
A polaridade das ligações covalentes influencia as propriedades dos compostos, como ponto de fusão, ponto de ebulição e solubilidade. Por exemplo, a água é uma molécula polar devido à diferença de eletronegatividade entre o oxigênio e o hidrogênio, o que resulta em um momento dipolar.
Essa polaridade é responsável pelas altas propriedades de ponto de ebulição e solubilidade da água.
Ao concluir nossa análise de Exemplos De Ligações Iônicas E Covalentes, destacamos a importância de entender as diferenças e similaridades entre esses dois tipos de ligações. A capacidade de identificar os tipos de ligação presentes em compostos é essencial para prever suas propriedades e reatividade.
A aplicação da regra do octeto e a compreensão da polaridade das ligações covalentes fornecem ferramentas valiosas para a interpretação e previsão do comportamento de moléculas.

